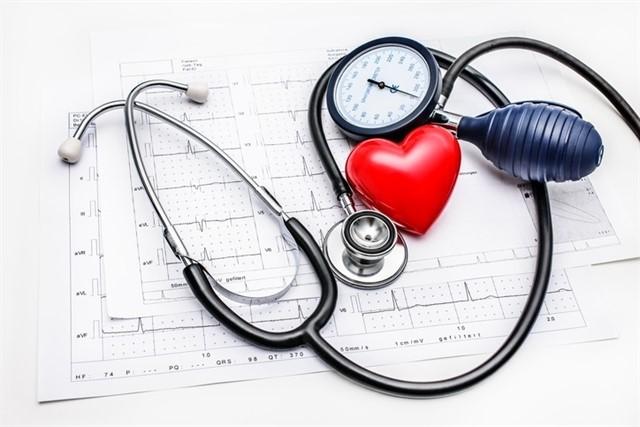
 La Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) amplió el retiro del mercado de varios medicamentos recetados para controlar la presión sanguínea debido a la presencia de un cancerígeno.
La Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) amplió el retiro del mercado de varios medicamentos recetados para controlar la presión sanguínea debido a la presencia de un cancerígeno.
Con estos últimos anuncios, suman ya cuatro los retiros hechos en tan sólo una semana y forman parte de una investigación más amplia que comenzó en julio del año pasado debido a las impurezas halladas.
Le puede interesar:
Estudio sugiere FDA no supervisó pruebas
Hima San Pablo Puerto Rico tiene fórmulas en cáncer
Torrent Pharmaceuticals Limited retiró 60 lotes de comprimidos de potasio de Losartán USP y 54 lotes de comprimidos de Losartán de potasio / hidroclorotiazida por contener cantidades mínimas de ácido N-metilnitrosobutírico (NMBA). La farmacéutica dijo que solo estaba retirando aquellos lotes en los cuales el NMBA estaba por encima de los niveles de ingesta diaria aceptables publicados por la FDA.
Aquí puedes ver los lotes afectados:
https://www.fda.gov/Safety/Recalls/ucm632509.htm
FDA aprueba nueva bomba de insulina
AurobindoPharma USA, Inc. también anunció el viernes que está retirando del mercado 38 lotes de tabletas de Amlodipina, Valsartán, y Valsartán tabletas. La impureza encontrada es la N-nitrosodietilamina (NDEA).
El retiro es una expansión de una que emitió el 31 de diciembre de 2018. Los detalles sobre este retiro los puedes encontrar en este enlace: https://www.fda.gov/Safety/Recalls/ucm632442.htm
Macleods Pharmaceuticals Limited emitió un retiro del mercado en un lote de tabletas combinadas de Losartán de Potasio / Hidroclorotiazida por contener NDEA.
Camber Pharmaceuticals, Inc., retiró 87 lotes de Losartan Tabletas el 28 de febrero por NMBA. Fue el primero de todos los recordatorios desde el verano pasado que involucraron a NMBA. Los otros fueron para NDEA y N-nitrosodimetilamina (NDMA).
“Estamos profundamente preocupados por la presencia de una tercera impureza de nitrosamina en ciertos medicamentos ARB (bloqueadores del receptor de la angiotensina II), pero es importante subrayar que, según la evaluación inicial de la FDA, el aumento del riesgo de cáncer para los pacientes con exposición a NMBA parece ser igual para la exposición a NDMA pero menor que el riesgo de la exposición a NDEA “, aclaró el comisionado de la FDA, Scott Gottlieb en un comunicado.
La FDA dijo que las impurezas podrían estar produciéndose cuando hay reacciones entre sustancias químicas específicas durante proceso de fabricación, aunque también puede ser resultado de usar materiales como solventes.
La información fue colgada en el portal www.telemundoatlanta.com





