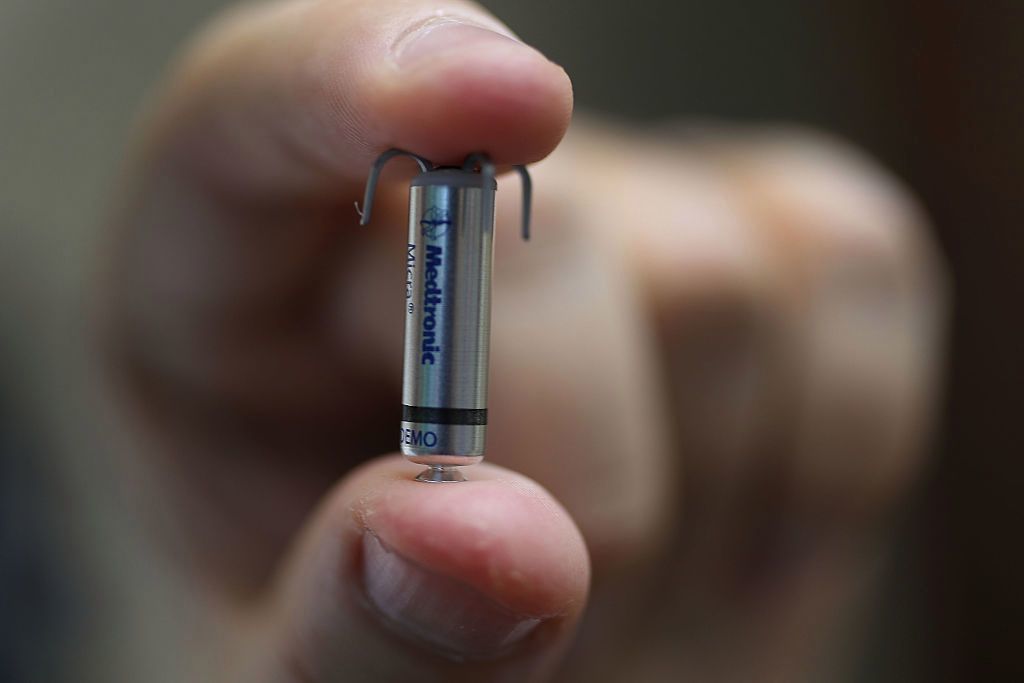
La Administración de Alimentos y Medicamentos (FDA), ordenó el retiro del mercado de miles de marcapasos vendidos por Abbott durante casi cuatro años.
La decisión fue tomada luego de recibir varios reportes de riesgo de cortocircuitos eléctricos que pueden resultar debido a la entrada de humedad en los dispositivos.
Dijo que se trata de 61 mil 973 marcapasos Scalable Bradycardia Platform (SBP), que se vendieron bajo los nombres Assurity y Endurity entre el 29 de abril de 2015 y el 20 de febrero de 2019.
Le puede interesar:
Conozca los trabajos actuales en enfermedades cardiovasculares de la RCC
Los marcapasos implantables detectan cuándo el corazón está latiendo demasiado lento y envían una señal al corazón para estimular el ritmo correcto.
Antes de fusionarse con Abbott en enero del 2017, el fabricante de marcapasos era conocido como St. Jude Medical.
Los cortocircuitos eléctricos que desencadenaron el retiro pueden hacer que los dispositivos dejen de estimular el ritmo cardíaco, envíen a los médicos información incorrecta o agoten la batería más rápido de lo esperado.
Le puede interesar:
Resonancia magnética cardíaca en la miocardiopatía chagásica crónica
Además, pueden afectar a los indicadores que alertan a los médicos cuando es necesario reemplazar un marcapasos, según https://noticiasya.com.
El organismo de regulación que recibido 135 informes de lesiones, identificó el retiro como de Clase I, su tipo más grave, debido al riesgo de lesiones graves o muerte.
Explicó que si el dispositivo no puede acelerar el ritmo cardíaco de manera eficaz, el usuario puede experimentar latidos cardíacos lentos o irregulares, desmayos, dificultad para respirar, cansancio, mareos o molestias.
Le puede interesar:
FDA emite alerta por mascarillas que irritan la piel
Además, es posible que no se proporcione el tratamiento necesario si el dispositivo no transmite información precisa.
Los marcapasos registran y transmiten las lecturas de manera inalámbrica a los médicos en un proceso conocido como telemetría.
Abbott culpó del defecto que permitió que la humedad entrara en algunos dispositivos a la mezcla incompleta de un epoxi durante la fabricación. Ninguno de los dispositivos afectados todavía está disponible para ser implantado.