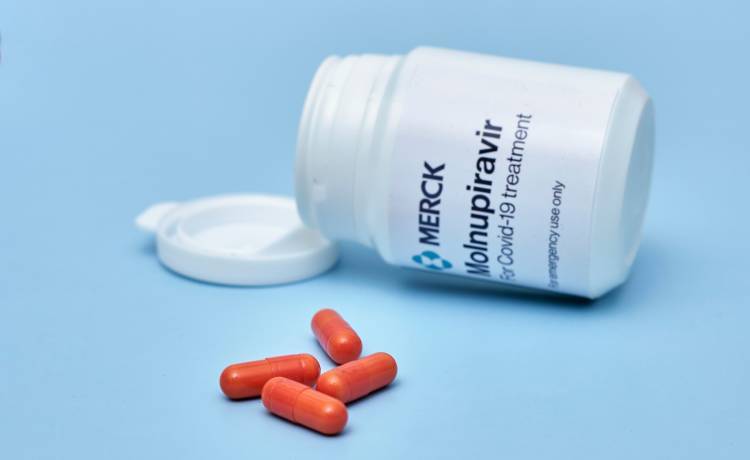
 Santo Domingo.- Una casa comercial del país comercializará la píldora aprobada para uso de emergencia en covid-19.
Santo Domingo.- Una casa comercial del país comercializará la píldora aprobada para uso de emergencia en covid-19.
Los asesores de la Administración de Alimentos y Medicamentos de Estados Unidos (FDA,) votaron el martes 13-10 a favor de recomendar la autorización de uso de emergencia de una píldora fabricada por Merck y Ridgeback Biotherapeutics para ayudar a tratar el covid-19.
De acuerdo a informaciones obtenidas por Resumen de Salud, el anunio será hecho en las proximas semanas.
La comercialización se logró gracias a un acuerdo con las multinaciones que producen el fármaco.
Los miembros del Comité Asesor de Medicamentos Antimicrobianos de la FDA quedaron dividido en la votación para recomendar el molnupiravir, que puede reducir el riesgo de que alguien evolucione hacia una enfermedad grave o la muerte en aproximadamente un 30%.
Este es un medicamento antiviral oral en investigación, para el tratamiento de COVID-19 leve a moderado en adultos con resultados positivos de pruebas virales del SARS-CoV-2 directas que tienen un alto riesgo de progresar a COVID-19 grave y / o de hospitalización.
Le puede interesar:
Merck solicita a la FDA autorización de molnupiravir para covid
Para que las píldoras sean eficaces, deben tomarse en los cinco días siguientes al inicio de los síntomas, y las personas deben tomarlas dos veces al día durante cinco días. Los miembros del comité estaban preocupados por los riesgos para las mujeres embarazadas.
La FDA no está sujeta a la orientación del comité, pero tiene en cuenta sus consejos.
“El resultado positivo de la reunión del Comité Asesor de la FDA de hoy, luego de una revisión exhaustiva de molnupiravir, incluidos los datos convincentes del estudio MOVe-OUT que demuestran una reducción significativa en las hospitalizaciones y muertes, es un paso fundamental para llevar este prometedor medicamento oral para COVID- 19 a los pacientes apropiados en los EE. UU.”, afirmó Merck
“Con la continua propagación del virus y la aparición de variantes, se necesitan con urgencia tratamientos adicionales para COVID-19. Es por eso que nos estamos moviendo con rapidez y rigor para buscar autorizaciones y acelerar el acceso global amplio a este medicamento en investigación ”, dijo el Dr. Dean Y. Li, vicepresidente ejecutivo y presidente de Merck Research Laboratories.
“Agradecemos a los miembros del Comité Asesor que revisaron nuestra solicitud, así como a los pacientes e investigadores que participaron en nuestros ensayos clínicos, y continuaremos trabajando con la FDA a medida que la agencia complete su revisión”.
Actualmente el Reino Unido autoriza el molnupiravir antiviral de Merck/Ridgeback Biotherapeutics para tratar el covid-19 leve a moderado
Molnupiravir no es el único antiviral que los científicos están desarrollando contra el covid-19.
El beneficio de eficacia con el tratamiento con molnupiravir fue constante en los subgrupos de pacientes importantes, incluidos los pacientes infectados con las variantes preocupantes del SARS-CoV-2, Delta, Gamma y Mu.
Por su parte Pfizer solicitó este mes la autorización para su píldora antiviral. La FDA aún no ha fijado una fecha para que su panel asesor revise ese medicamento.






